更新日:2023.1.26
製造業におけるデータインテグリティとは【総論編】では、データインテグリティの概要について記載しました。 本コラムでは、データライフサイクルの起点となる「データの記録」について記載します。
データインテグリティで取り扱うデータは多岐にわたる
工場の仕事は独立したものでなく、新製品開発からアフタサービスまでの一連の企業活動の中で機能しています。「製造現場」にフォーカスすれば生産指示を受けて出庫するまでですが、そこでは人が使う帳票類から設備が生み出すデータまで多岐にわたる情報が生まれています。
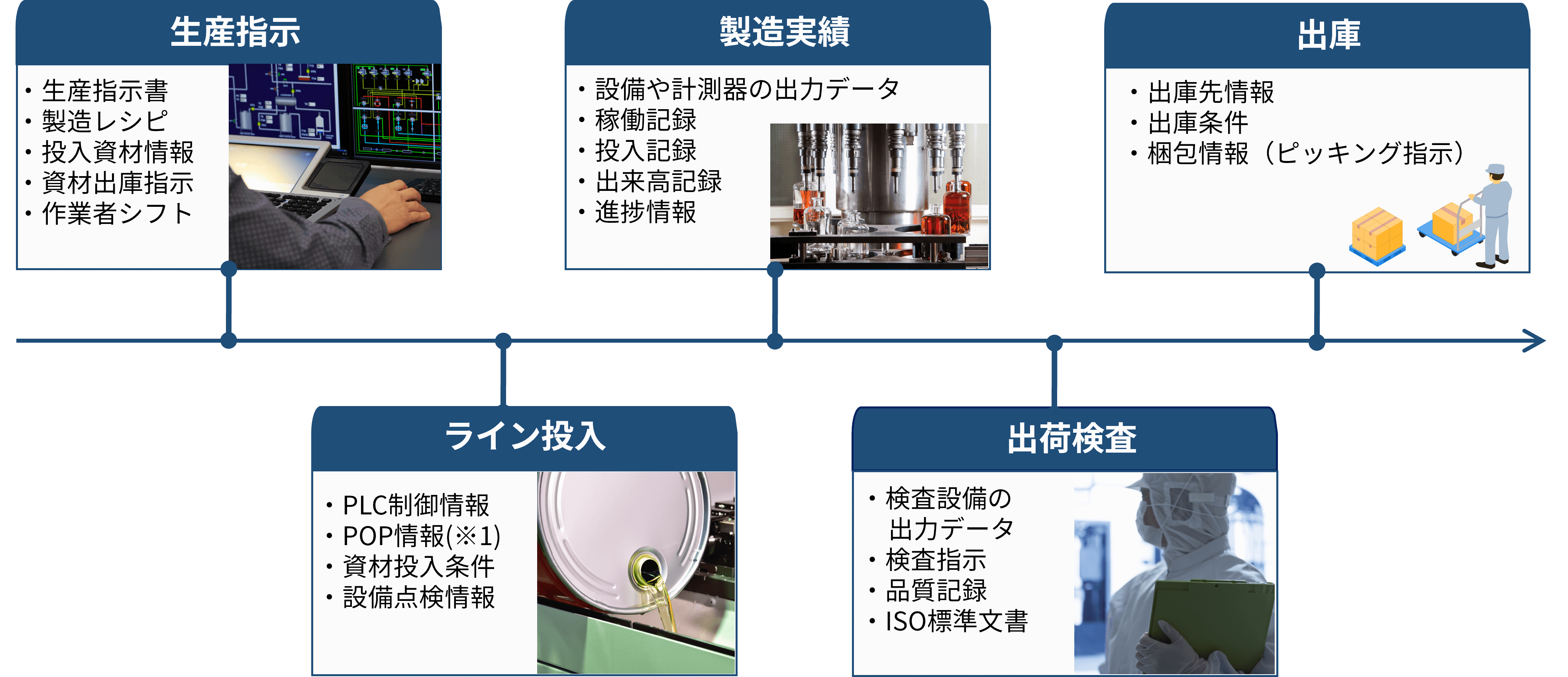
(※1)POP・・・Point Of Productionの略。刻一刻と変化する各工程の機械・設備・作業者・ワークの情報をリアルタイムに収集し、管理すること。
こうしたものが工程×設備分存在し、製品や設備によっては固有のドキュメントが必要になってきます。 例えば製薬では製造工程中でも中間品質検査を行いますが、過程や結果保管などについて定めたマニュアル、指示書、結果報告等が必要となります。
NAVINECTで品質向上をサポートするなら···
データインテグリティにおける紙運用のポイント
このようにして生まれたデータの管理手法について、PIC/S(※2)のガイダンス「GOOD PRACTICES FOR DATA MANAGEMENT AND INTEGRITY IN REGULATED GMP/GDP ENVIRONMENTS」に紙運用のポイントが示されています。全体ボリュームが大きいため、簡単に抜粋しご紹介します。
生成
- すべての文書は一意の識別子が必要であり、チェック、承認、サイン、日付が必要である。
- 紙切れなど一時的な記録は禁止されるべきである。
配布と管理
- 更新されたバージョンはタイムリーに配布されるべきである。
- 廃止されたマスター文書とファイルはアーカイブし、アクセスを制限する必要がある。
記録
- 手書きの記録は作業者が作成する。
- 手書きの記録は明確で読みやすい必要がある。
修正
- 初期と変更日の日付を記載する。
- 修正は消えないインクで行う必要がある。
検証
- 重要なプロセスステップの記録は
‐操作時に独立し指定された人によりレビュー/立ち合いされる必要がある。
‐品質部門に送る前に、製造部門の承認された人によりレビューされる必要がある。
保存
- 保管記録へのコントロール、アクセス、リカバリーに関する手順を整備する必要がある。
1つ1つは納得感のある内容ですが、実際に日々の業務で順守を徹底するとなると、作業者の負担が無視できないものとなります。
※1 PIC/S
Pharmaceutical Inspection Convention and Pharmaceutical Inspection Co-operation Scheme(医薬品査察協定及び医薬品査察共同スキーム)
医薬品分野でのGMP基準及び査察当局の品質システムの国際的な開発・実施・保守を目的とした査察当局間の非公式な協力の枠組み。
データインテグリティにおけるデータ記録は【デジタル】
紙でもデジタルでもデータがガバナンスの下でALCOA原則に倣い、ライフサイクルを通して管理されていれば問題ありません。実際に、PIC/Sのガイダンスにも紙運用とデジタル運用の両方が記載されています。しかし、多岐にわたるデータ群を、PIC/Sが求める水準で紙管理することは現場に相当な負担を強いることになります。現場へのしわ寄せはミスを誘発し、手書きならではの抜け道は改ざんや偽装の温床となります。逆に言えば、データをデジタルで管理することで品質不正の芽をつぶすことができます。製造の近代化に伴い複雑なデータ生成や課題が発生している中では、有効で信頼できるシステムの下で管理を行うことが必須です。
【デジタルでは紙に比べて圧倒的にALCOAに対応しやすくなる】
| 紙運用の場合 | デジタル運用の場合 | |
|---|---|---|
|
Attributable (帰属性) 誰がいつデータを 作成したのかわかる |
・誤った日時などを入力してしまう可能性 |
・タイムスタンプや入力アカウントによりユーザーが意識せずに記録される ・システム連携の場合、連携元と時間は明らか |
|
Legible (判読性) 全てのデータが 判読・理解できる |
・判読しにくい手書き文字や独自の記号、略語が混入してしまう |
・汚れや字の問題で「判読できない」は発生しない ・システム連携の場合、判読できないデータは原則発生しない |
|
Contemporaneous (同時性) データ生成と記録が 同時にできる |
・人が作業をしながら記録をする必要がある | ・システム連携の場合、データ生成やバッチ実行のタイミングで自動記録 |
|
Original (原本性) データが原本である |
・記録原本(紙)の保管や管理が必要 | ・取得データをそのまま原本とみなせる |
|
Accurate (正確性) データが 事実に基づいている |
・記載ミスや漏れが起きる可能性がある | ・システム連携データであれば原則「入力ミス・入力漏れ」はない |
データインテグリティではデータの自動連携が前提
単に入力方法をデジタル化するだけなく、データを設備やシステムから連携することでさらなる入力負荷の軽減と改ざん防止が可能になります。PIC/Sのガイダンスでも、デジタル運用と装置データの自動連携はほぼ同義として述べられています。
データを自動連携するメリットは2つ 1.人が起因のミスや不正を極限まで少なくできる 2.人手とは比べ物にならないほど多くのデータをリアルタイムに取得できる 設備データ/センサーデータ/他システムデータなどを正確に収集し統合分析、またリアルタイムに監視することでより多面的な解決策の導出とトラブルへの早期対処が可能となります。

データインテグリティは医薬業界だけものではない
本来の意味で言う「データインテグリティ」や「ALCOA」は医薬業界に向けたものなので、そうでない企業はこれらすべてに対応する必要はありません。しかし、ALCOA原則はどの製造業にも当てはまる普遍的なデータ管理の基本を述べており、その考え方はどの製造業にも求められるものです。実際に自動車業界などは規制はなくとも自主的に取り組み始めています。
データインテグリティに取り組む意義
元より、データインテグリティに関するガイドラインは製品や工程の安全性と品質の担保を目的としています。つまり、製品品質を確保するための現場運用、システム要件、組織の在り方などが体系立ててまとめられています。医薬業界以外においても、データインテグリティの考え方を取り入れることで効率的に品質管理を向上させることが可能です。
デジタル化はデータインテグリティの第一歩
医薬業界以外においてもデータインテグリティの第一歩は「記録をデジタル化すること」です。
システム連携データであれば、「書き間違えた」「書き忘れた」「書いているけど読めない」は原則発生しません。また、改ざんもアクセス制御により物理的に阻止できるほか、操作ログ取得や収集データの量や複雑さによる改変の難しさから、心理的な抑止効果も期待できます。
冒頭でも述べた通り製造は複数の関連業務の連携の上に成り立っています。データをデジタルで管理することでシステム間の連携性が向上し、品質のみならずQDC全体の向上に役立つものとなります。
デジタル化のデメリット
全てのものがそうであるように、デジタル化にもデメリットはあります。 具体的には、 ■ システムコストがかかる ■ セキュリティ対策が必要になる ■ ITに知見のある人財が必要になる などがあります。 とはいえ、コスト以外はサービス選定である程度カバーできます。

例えばSaaS型のサービスを利用することでセキュリティやシステム運用をサービス提供者の責任範囲とすることが可能です。 自社仕様で構築する場合、製造設備や品質の考え方はオフィス系のシステムとは異なる特有の業務知識が求められます。ベンダーの技術者に製造システムの知見や経験があることは必須の条件です。 また提供しているサービスがきちんと社内実践され、活用ノウハウが蓄積されていることもポイントとなります。




